Cada vez son más los casos que se van diagnosticando que se ajustan a la descripción del síndrome de fallo de desarrollo peridestete (PFTS, por sus siglas en inglés) y los veterinarios de campo ya tienen en cuenta este proceso a la hora de realizar un diagnóstico diferencial en casos de desmedro en las primeras semanas de transición. El objetivo de este artículo es hacer una actualización de la información más reciente disponible sobre esta enfermedad.
Los primeros casos se describen en 2008 en USA y Canadá, y el síntoma más característico era la aparición de anorexia en lechones en la 1ª semana posdestete.
Los animales afectados experimentaban una pérdida progresiva de peso durante las semanas siguientes y manifestaban letargia. Los signos clínicos apuntaban a que podrían estar implicado alguno de los patógenos comunes en las explotaciones porcinas como circovirus porcino tipo 2 (PCV2), el virus influenza porcino o el del síndrome reproductivo y respiratorio porcino (PRRS), aunque la aparición de numerosos casos en explotaciones libres de virus PRRS e influenza y vacunados frente a PCV2 sugirieron que podría tratarse de un proceso distinto.
En un principio la enfermedad recibió distintos nombres, como “síndrome de caquexia posdestete” o “síndrome de desmedro catabólico posdestete”, pero en la International Pig Veterinary Society (IPVS) de Vancouver (Canadá) en 2010 se alcanzó un consenso sobre el nombre del proceso quedando 1nalmente como “síndrome del fallo de desarrollo peridestete” (Porcine periweaning failure to thrive syndrome).
Los principales signos clínicos y hallazgos macro y microscópicos de la enfermedad se recogen en la tabla 1.
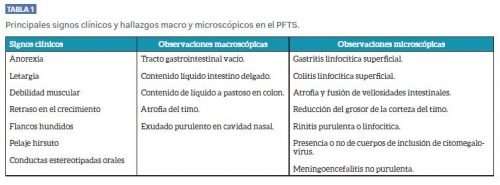
SIGNOS CLÍNICOS
La morbilidad de la enfermedad varía de 1 al 20%, aunque la mortalidad entre los animales afectados es muy alta. Durante la 1ª semana posdestete los lechones comienzan a manifestar anorexia, letargia y debilitación progresiva. Hacia la 2ª semana presentan los flancos hundidos, debilidad muscular, pelaje hirsuto y retraso del crecimiento, y hacia la 3º semana la mayoría de los animales afectados están muy debilitados y mueren o tienen que ser sacrificados.
En las granjas donde se detecta el problema se suelen observar comportamientos estereotipados orales como masticar y lamer, así como comportamientos de investigación excesivos, como hozar y rascar con las patas.
LESIONES
Las observaciones más comunes en las necropsias de los animales afectados son la aparición de un tracto gastrointestinal vacío o con escaso contenido, líquido en intestino delgado y de líquido a pastoso en intestino grueso. En los casos más avanzados hay atrofia manifiesta de timo, y en cavidad nasal a veces se aprecia material purulento.
A nivel microscópico, en timo se observa reducción en el grosor de la corteza, en estómago y colon se aprecia un infiltrado linfoide superficial y en intestino delgado atrofia y fusión de vellosidades. En la mucosa de la cavidad nasal se observa un infiltrado de neutrófilos o linfocitos, asociado a veces a la presencia de cuerpos de inclusión de citomegalovirus en las células glandulares. En encéfalo pueden aparecer manguitos perivasculares de linfocitos. Otras lesiones microscópicas observadas en ocasiones son neumonía intersticial, bronconeumonía purulenta, nefritis linfocítica, degeneración grasa del hígado y atrofia del tejido adiposo.
Los resultados de estudios realizados en granjas afectadas (Huang y Harding, 2015) indican que se debería considerar un diagnóstico de PFTS si el lechón afectado clínicamente presenta a la vez 3 de las lesiones microscópicas asociadas a la enfermedad: atrofia tímica, gastritis linfocítica superficial y en intestino delgado atrofia de vellosidades.
ETIOLOGÍA
La etiología de la enfermedad es algo que continúa sin esclarecerse hasta el momento. En muestras procedentes de animales afectados se ha buscado sin éxito una posible relación con la mayoría de los patógenos que afectan al ganado porcino, como las bacterias: Clostridium perfringens, Escherichia coli, Brachyspira hyodysenteriae, Brachyspira pilosicoli, Salmonella enterica, Bordetella bronchiseptica, Streptococcus suis, Haemophilus parasuis y Pasteurella multocida, y los virus: PRRS, PCV2, virus influenza porcino, rotavirus, virus de la gastroenteritis transmisible, virus de la encefalomielitis hemaglutinante, citomegalovirus porcino, calicivirus entérico, suis herpesvirus 2 o torquetenovirus. También se ha intentado reproducir sin éxito la enfermedad en cerdos gnotobióticos a través de homogeneizados de tejidos de animales afectados aplicados por diferentes vías: oral, o combinada oral-intramuscular y oral-intraperitoneal.
Tampoco han tenido éxito los intentos de asociar el proceso con la presencia de insertados de retrovirus endógenos porcinos (PERv).
Intervenciones en otros ámbitos para descartar causas de manejo, ambientales o alimentarias, tales como revisiones en las dietas, mayores controles en la ventilación y temperatura de las instalaciones, modificación de los planes vacunales, etcétera, no han dado tampoco ningún resultado.
DEFINICIÓN DE UN CASO DE PFTS
Debido a que no tenemos una etiología conocida que buscar, el diagnostico de esta enfermedad se basa en que las manifestaciones que presenten los animales se puedan encuadrar o no dentro de la definición de un caso de PFTS, que fue propuesta por Huang et al. en 2011 (Journal of Swine Health and Production) y que dice: “enfermedad que se caracteriza clínicamente por la progresiva debilitación de los cerdos de transición en ausencia de factores infecciosos, nutricionales, de manejo o ambientales perjudiciales discernibles que puedan explicar el síndrome clínico. Al destete los cerdos afectados tienen un peso superior al peso medio y ni los animales afectados ni sus compañeros de cuadra muestran ninguna evidencia de enfermedad residual de la fase de lactación. Dentro de los 7 días posdestete los animales afectados están anoréxicos y letárgicos. Se van deteriorando y dentro de las 2-3 semanas posteriores al destete muestran una marcada debilidad muscular y pérdida de la condición corporal. En las granjas afectadas algunos animales muestran comportamientos estereotipados orales como lamer, morder o masticar.
En las granjas afectadas la mortalidad y la morbilidad varían a lo largo del tiempo, pero la mortalidad es alta”.
¿CUÁL ES EL PAPEL DE LA GENÉTICA EN EL PFTS?
Probablemente en la genética de la enfermedad es el campo donde más avances se han producido en los últimos 5 años. Poco tiempo después de la aparición de este síndrome se empezó a especular con la influencia que podían tener ciertas estirpes de cerdos en su prevalencia. En 2015, mediante un planteamiento simple, un grupo de veterinarios españoles consiguió demostrar que había una relación entre ciertos individuos y la aparición de esta enfermedad (Ramis et al., 2015).
Haciendo test de paternidad de animales enfermos y sanos, procedentes de granjas españolas y polacas, se encontró que, en algunos casos, hasta el 50% de los lechones que mostraban PFTS clínico eran hijos de un mismo verraco; y sin embargo, al analizar animales sanos de las mismas granjas, los verracos sospechosos eran padres de muy pocos de estos lechones sin enfermedad. Esta evidencia se ha confirmado en numerosas ocasiones, aunque en otras, el cambio de los verracos no condujo a una mejoría de le enfermedad.
A partir de esta 1ª aproximación se han hecho diversos estudios tratando de identificar el mecanismo relacionado con la herencia que produce predisposición a sufrir la enfermedad. Los 3 estudios que conocemos se han hecho mediante análisis de polimorfismos de una sola base (SNPs); se estudia qué nucleótido hay en un punto concreto del ADN de los animales y se trata de establecer una relación entre la base que aparece en los animales sanos y la que aparece en los animales enfermos. Esto se llama estudio de asociación y normalmente involucra una cantidad muy alta de SNPs (más de 60.000) en todos los cromosomas del cerdo. El mismo equipo español, estudiando 38 animales enfermos y 10 sanos, trató de hacer un análisis de asociación mediante un panel de 60K SNPs para encontrar alguna relación entre la aparición de la enfermedad y alguno de esos marcadores analizados, sin encontrar ninguna relación evidente, tan solo 2 puntos sugestivos no significativos en los cromosomas 4 y 9.
En 2016, un grupo brasileño (Zanella et al., 2016) haciendo el mismo tipo de análisis, pero con una muestra mayor (48 enfermos y 19 sanos) y usando el mismo panel de 60K SNPs, encuentran una asociación moderada entre la presencia de la enfermedad y un marcador del cromosoma X y además, una región del cromosoma 14 parece tener 2 áreas que podrían estar relacionadas con la enfermedad.
El hecho de que la mutación con mayor asociación esté en el cromosoma X podría sugerir una relación con el sexo de los animales, pero los investigadores no han conseguido demostrarlo al introducir esta variable en el modelo; la enfermedad aparece con la misma frecuencia en machos que en hembras.
En 2018 se hace un nuevo estudio en EE.UU. (Bertolini et al., 2018), usando en esta ocasión 80 animales enfermos y 39 sanos y un panel con 80.0000 SNPs, de los que se analizaron más de 68.000. En este caso, encuentran 4 zonas, en los cromosomas 1, 3, 6 y 11, siendo las más significativas las que están en los cromosomas 3 y 11.
Pero, ¿Qué genes hay en esas regiones detectadas por los 3 equipos estudiando el PFTS? ¿Qué relación podrían tener estos genes con la aparición de PFTS? El equipo español, dado que la relación entre los SNPs sugestivos no fue significativa, no buscaron genes candidatos a estar involucrados en la enfermedad. El equipo brasileño, determina que en las zonas significativas que encuentra, hay genes como SLIT2 (guía de hendidura ligando 2), SNAX (factor X asociado a translina), GNPAT (gliceronafosfato O-aciltransferasa), ARV1 (homólogo de ARV1), EGR2 (respuesta 2 de crecimiento precoz) o SIRT1 (sirtuina 1), que, aunque en el cerdo no se han estudiado, en otras especies están relacionados con desórdenes neurológicos, alteraciones del comportamiento o depresión ante el estrés. Esto podría estar relacionado con los síntomas nerviosos que se aprecian en los lechones con PFTS. El equipo norteamericano encuentra otros genes candidatos como ROR1 (cromosoma 6) relacionado con alteraciones neurológicas en humanos, PDE10A (cromosoma 1) relacionado con alteraciones en el comportamiento e hipoactividad en ratones, CUL4A (cromosoma 11) relacionado en ratones con atrofia de vellosidades intestinales, reducción de tamaño en el timo y atrofia muscular o ATP4B (cromosoma 11) relacionado también en ratones con alteraciones de la morfología de la mucosa gástrica.
Cabe recordar que estos genes candidatos explicarían la aparición de síntomas como la depresión, las estereotipias, la anorexia, la pérdida acelerada de peso, la atrofia tímica o la gastritis que se produce en los lechones que presentan un cuadro clínico de PFTS.
Es esperable que se puedan establecer pruebas genómicas que permitan identificar a priori que progenitores podrían propiciar la aparición de esta enfermedad, pero esto aún es cosa del futuro.
¿QUÉ PUEDO HACER SI TENGO PFTS EN MI GRANJA?
Esta es la gran pregunta que se hace el veterinario que se enfrenta a un problema por esta enfermedad en su granja, pero es muy difícil de contestar, ya que se desconoce hasta el momento la etiología del proceso. Lo que si podemos hacer es dar unas recomendaciones generales, entre las que se incluirían:
- Observar detenidamente los animales durante las primeras semanas postdestete para localizar aquellos que puedan presentar los signos clínicos propios del síndrome. Revisar también los animales durante la lactación para comprobar que no presentan ningún proceso que pueda desencadenar la aparición de lechones enfermos después del destete.
- Revisar minuciosamente las condiciones ambientales, de manejo y nutricionales de la explotación.
- Revisar el historial de la granja en todas las fases de producción.
- Enviar animales enfermos a laboratorio para realizarles un estudio completo que incluya la necropsia, estudio histopatológico y todas las pruebas diagnósticas necesarias. Si es posible enviar también animales sanos compañeros de cuadra de los enfermos.
- Tomar muestras de agua y pienso y enviarlas a analizar con el fin de descartar la presencia de sustancias tóxicas, desequilibrios nutricionales y comprobar la calidad de los ingredientes.
- Hacer test de paternidad para tratar de determinar si hay algún/os verraco/s que produzcan la mayoría de los lechones enfermos. Si se llega a identificar los padres implicados, no se deberían hacer más cubriciones con ellos y habría que sustituirlos. No se ha podido establecer una relación directa con un genotipo concreto, sino con individuos dentro de los genotipos.
- Conviene no olvidar que probablemente la implicación genética es poligénica y la mitad de la responsabilidad es de las cerdas.
Autores: Pallarés FJ, Ramis S G. Facultad de Veterinaria. Universidad de Murcia
Fuente: Anaporc


Deja un comentario