Los espermatozoides de cerdo ibérico pueden ser más susceptibles a la peroxidación lipídica durante el proceso de crioconservación debido al alto contenido de ácidos grasos poliinsaturados de sus membranas. Por lo tanto, el objetivo de este estudio fue evaluar el efecto de 3 antioxidantes (glutatión reducido, α-tocoferol e hidroxitirosol) cuando estos son incluidos en los medios de enfriamiento-congelación o en el medio de descongelación. Se utilizaron 12 eyaculados de cerdos ibéricos sanos y se criopreservaron con un protocolo adecuado para esta raza porcina. Se evaluaron distintos parámetros de calidad espermática a los 30min y 150min post-descongelación: porcentaje de espermatozoides con el acrosoma intacto (EAI), vivos (EV), mótiles totales (EMT) y mótiles progresivos (EMP). Además, se evaluaron diferentes parámetros relacionados con balance redox en los mismos tiempos de incubación. La inclusión de antioxidantes en el medio de enfriamiento-congelación mejoró EV, EAI, EMT y EMP, pero solo estos 2 últimos parámetros mejoraron al incluir los antioxidantes en el medio de descongelación, especialmente a lo largo del tiempo de incubación. Los resultados mostraron diferencias en la producción de sustancias oxígeno reactivas y la capacidad antioxidante total entre los tratamientos que incluyen antioxidantes en el medio de enfriamiento-congelación o en el medio de descongelación, sin diferencias entre tratamientos en la peroxidación lipídica y alcanzando todos valores similares en el tiempo. En conclusión, sería aconsejable incluir antioxidantes, especialmente glutatión reducido, en el medio de enfriamiento-congelación. E incluir antioxidantes en el medio de descongelación podría mantener una mayor motilidad de los espermatozoides a en tiempo.
Introducción
El cerdo ibérico es una raza porcina autóctona de España, que tiene un alto valor ecológico, económico y cultural al estar su producción ligada con la dehesa, la producción rural y la obtención de productos de alto valor organoléptico. Pero su censo y por tanto su variabilidad genética se ha visto afectado a lo largo de los años por factores como la Peste Porcina Africana, el cruce con la raza duroc, su menor uso en sistemas de producción intensivo debido a su menor rendimiento productivo y reproductivo, o la elección de solo determinadas variedades de cerdo ibérico con mejores caracteres productivos, relegando al resto de variedades a una situación real de peligro de extinción (Herrero-Medrano et al., 2013). En este contexto, la creación de bancos de recursos zoo-genéticos podría mejorar el manejo de estas poblaciones y preservaría su riqueza genética. Así la congelación de semen es una excelente manera de preservar material genético de alto valor (Johnson et al., 2000), y tiene especial relevancia en el cerdo ibérico, ya que es en especial en el macho el que más reducido se ve su número, debido a que la inseminación artificial hace que el número de machos necesarios para la reproducción sea muy bajo (1 macho por cada 100 hembras), o que el 95% de los cerdos Ibéricos producidos actualmente son cruzados (hembra ibérica pura y macho de raza duroc) (MAPA, 2019). Un número reducido de machos implica una pérdida de variabilidad, un peligro añadido en las distintas variedades que son cada vez menos usadas. Pero la implementación del uso de sistemas de crioconservación espermático tiene que ir de la mano de la mejora de los mismos, ya que los actuales protocolos de congelación y descongelación afectan negativamente a la función y supervivencia espermática, causando una reducción en el rendimiento reproductivo (Johnson et al., 2000; Yeste, 2017).
Algunos autores determinan que gran parte de los problemas derivados de la criopreservación son derivados de un estrés oxidativo, causado por un exceso de producción de sustancias oxigeno reactivas (ROS) (Awda et al., 2009), y una disminución del sistema endógeno de defensa antioxidante (Gadea et al., 2004; Barranco et al., 2015), que provoca cambios físicos y químicos en la membrana espermática (Watson, 1995). Además, las membranas espermáticas de la especie porcina son ricas en ácidos grasos poliinsaturados (Maldjian et al., 2005), lo que las hace más susceptibles a sufrir daños por peroxidación lipídica (Awda et al., 2009). Y en este sentido, el cerdo ibérico podría verse más afectado por este daño, ya que la composición lipídica de sus membranas espermáticas tiene un alto contenido en ácidos grasos mono y poliinsaturados (de Mercado et al., 2011).
Para evitar los posibles daños oxidativos son muchos los estudios que han investigado la adición de antioxidantes a los medios de congelación (Gadea et al., 2005a; Breininger et al., 2011; Yeste et al., 2014; Pei et al., 2018), y descongelación (Gadea et al., 2005b; Gadani et al., 2017; Weng et al., 2018) pero no siempre con los mismos resultados. Y hasta donde sabemos, no hay estudios reportados que hayan probado el efecto de los antioxidantes en el proceso de criopreservación espermática de cerdo ibérico, por tanto, sería necesario determinar que antioxidantes podrían ser los más eficaces en esta raza. La disparidad de resultados y el alto número de compuestos con capacidad antioxidante hace difícil saber cuáles serían los más óptimos para el estudio en esta raza. El glutatión reducido ha tenido buenos resultados por distintos autores en su uso en los protocolos de congelación y descongelación de semen de porcino (Gadea et al., 2005a,b), y lo mismo ocurre con el α-tocoferol (Jeong et al., 2009; Breininger et al., 2011). Por otra parte, el hidroxitirosol, un compuesto fenólico extraído del aceite de oliva virgen, ha demostrado tener varios efectos biológicos beneficiosos, entre ellos una alta actividad antioxidante (Tripoli et al., 2005), y ha presentado buenos resultados en otras especies (Kedechi et al., 2017; Arando et al., 2019), pero no ha sido testado aun en la especie porcina.
Por lo tanto, el objetivo de este estudio fue evaluar el efecto protector de estos 3 antioxidantes (glutatión reducido, α-tocoferol e hidroxitirosol), determinando su efecto al añadirse en el medio de congelación o en el medio de descongelación, valorando diferentes parámetros de calidad espermática y estrés oxidativo.
Material y métodos
Diseño Experimental
Para este estudio, se evaluaron 3 antioxidantes diferentes no probados en la raza de cerdo ibérico, el glutatión reducido, el α-tocoferol y el hidroxitirosol. Para el glutatión reducido se seleccionó la concentración de 1mM, ya que es la que ha mostrado buenos resultados tanto en su adición en el medio de congelación como en el medio de descongelación (Gadea et al., 2005a,b). Para el α-tocoferol se seleccionó la concentración de 200μg/ml, la cual se ha observado como la que obtenía mejores resultados post-descongelación en distintos estudios (Jeong et al., 2009; Breininger et al., 2011). Por último, como el hidroxitirosol no ha sido testado hasta ahora en la raza porcina, se hizo una prueba previa (datos no incluidos) en base a los resultados de Kedechi et al., 2016, donde la concentración de 200μg/ml fue la que mejores resultados obtuvo.
Se evaluó el efecto de los antioxidantes cuando fueron añadidos al medio de enfriamiento-congelación (tratamientos con el acrónimo LEY) o al medio de descongelación (tratamientos con el acrónimo BTS). Obteniendo así un total de 7 tratamientos diferentes:
- Tratamiento A: un control que no incorporaría antioxidantes ni en el medio de enfriamiento-congelación, ni en el medio de descongelación.
- Tratamientos GSH-LEY y GSH-BTS: tratamientos que incorporarían 1mM de glutatión reducido, en el medio de enfriamiento-congelación (GSH-LEY) o en el medio de descongelación (GSH-BTS).
- Tratamientos TOC-LEY y TOC-BTS: tratamientos que incorporarían 200μg/ml de α-tocoferol, en el medio de enfriamiento-congelación (TOC-LEY) o en el medio de descongelación (TOC-BTS).
- Tratamientos HIDROX-LEY y HIDROX-BTS: tratamientos que incorporarían 200μg/ml de hidroxitirosol, en el medio de enfriamiento-congelación (HIDROX-LEY) o en el medio de descongelación (HIDROX-BTS).
En cada tratamiento fue analizada la calidad espermática y estrés oxidativo a los 30min y 150min de incubación post-descongelación.
Animales, recuperación del semen y protocolo de congelación-descongelación
Todos los procedimientos fueron llevados a cabo en conformidad con la normativa específica de la Directiva del Consejo de la Unión Europea (2010/63/UE) y el Gobierno de España (RD 53/2013), y previamente aprobados por el Comité de Ética del Instituto Tecnológico Agrario de Tecnología de Castilla y León (ITACyL).
En este estudio se utilizaron un total de 12 eyaculados de diferentes verracos ibéricos (AIM, Segovia, España), obtenidos mediante método manual y diluidos en el diluyente Beltsville Thawing Solution (BTS) (Pursel y Johnson, 1975) (1:1, v/v), después de lo cual fueron transportados al laboratorio del Centro de Pruebas de Porcino (ITACyL) a 15-17 °C.
Los espermatozoides se congelaron utilizando un protocolo de crioconservación adecuado para cerdo ibérico (de Mercado et al., 2010). Brevemente, las muestras de semen diluidas para el trasporte se centrifugaron a 2400g durante 3min a 15°C. Los pellets resultantes se diluyeron en un medio de enfriamiento LEY (80% (v/v) de β-lactosa (310mM), 20% (v/v) de yema de huevo, 100μg/ml de sulfato de kanamicina; 330 ± 5mOsm/kg; pH ajustado a 7,2) hasta una concentración de 1,5 × 109 células/ml. Después de enfriar las muestras hasta 5°C en 120min en un baño de agua termostático programable, los espermatozoides fueron rediluidos hasta una concentración final de 1 × 109 células/ml con un medio de congelación LEYGO (92,5% de diluyente LEY, 1,5% Equex STM y 6% de glicerol (v/v); 1650 ± 15mOsm/kg, pH ajustado a 7,2. A continuación, las muestras se cargaron en pajuelas de 0,5ml, se sellaron y se transfirieron a un congelador programable donde se congelaron de la siguiente manera: desde 5°C a –5°C a un ratio de 6°C/min, desde –5°C a –80°C a 40°C/min; se mantuvieron 30s a –80°C, para a continuación enfriar las muestras a 70°C/min hasta una temperatura final de –150°C, paso en el cual fueron sumergidas en nitrógeno líquido, donde permanecieron almacenadas hasta su análisis. Los antioxidantes correspondientes a cada tratamiento que se incorporaban en el medio de enfriamiento-congelación (GSH-LEY, TOCLEY y HIDROX-LEY) fueron añadidos antes de iniciar el proceso tanto en el medio LEY como en el LEYGO, para que la concentración de los mismos fuera siempre la misma durante todo el proceso.
La descongelación se realizó sumergiendo las pajuelas en un baño de recirculación de agua a 37°C durante 20s, diluyéndolas acto seguido en BTS (1:1, v/v) atemperado a 37°C. Estas muestras se incubaron en el baño de agua a 37°C hasta los 150min, y se evaluó la calidad espermática y los parámetros relacionados con el estrés oxidativo a los 30min y 150min post-descongelación. Los antioxidantes correspondientes a cada tratamiento que se incorporaban en el medio de descongelación (GSH-BTS, TOC-BTS, HIDROX-BTS) fueron añadidos antes comenzar la descongelación.
Evaluación de calidad espermática post-descongelación
Análisis del estado del acrosoma
La morfología del acrosoma se evaluó mediante microscopía de contraste de fase ×1000. Las muestras se fijaron en glutaraldehído al 2%, examinándose un mínimo de 200 acrosomas por muestra. El daño del acrosoma se clasificó por el sistema de puntuación reportado por Pursel et al. (1972), determinándose el porcentaje de espermatozoides con el acrosoma intacto (EAI, %).
Análisis de la viabilidad espermática
La viabilidad fue evaluada mediante la determinación de la integridad de la membrana plasmática de los espermatozoides, mediante una técnica que combinaba el uso de la fluorescencia y la microscopía de contraste de fase, como describen Tomás et al. (2014). Las muestras espermáticas, se tiñeron con 5µl de yoduro de propidio (IP, 0,5mg/ml) y se incubaron a 37°C en la oscuridad durante 10min. Posteriormente, las muestras se analizaron utilizando microscopía de contraste de fase, combinada con un equipo de fluorescencia con una lámpara de mercurio (100W) y un filtro Nikon G-2A (excitación/barrera de 510/590) que permite una excitación simultánea de azul y verde. Después de observar la muestra bajo microscopía de contraste de fase, se conectó la fluorescencia mostrando los espermatozoides no viables de color rojo, y los espermatozoides viables sin teñir, pero visibles por contraste de fases. Se examinaron un mínimo de 300 células por portaobjetos, en campos aleatorios en cada muestra. Solo se consideró en los resultados el porcentaje de espermatozoides con membrana plasmática intacta como espermatozoides vivos (EV; %) (espermatozoides no teñidos de rojo por el IP).
Análisis de la motilidad
Los parámetros de calidad del movimiento se evaluaron objetivamente utilizando un sistema computarizado de análisis de semen operando a 25 frames por segundo (25Hz), con un ajuste de área de partículas de 10µm a 80µm, y un radio de búsqueda de 11µm. Los espermatozoides se definieron como no mótiles si su velocidad media (VAP) era inferior a 10µm/s; y los espermatozoides se consideraron mótiles progresivos si exhibían una VAP > 45µm/s y un índice de rectitud (STR) 45% (Cremades et al., 2005).
Para este análisis se tomaron alícuotas de 3µl de cada muestra espermática en una cámara Makler precalentada (38°C) (Sefi Medical Instruments, Haifa, Israel). De cada muestra se analizaron 5 campos, evaluando un mínimo de 100 espermatozoides por campo, evaluándose los siguientes parámetros espermáticos: porcentaje de espermatozoides motiles totales (EMT; %) y porcentaje de espermatozoides motiles progresivos (EMP; %).
Producción de sustancias oxígeno reactivas (ROS)
La determinación de ROS se realizó según el protocolo de Hayashi et al. (2007) con modificaciones para células espermáticas. El análisis se realizó en placas de 96 pocillos, usando 5μl de una solución estándar de peróxido de hidrógeno (para la generación de una curva de calibración) o de muestra. A esta cantidad se añadieron 40μl de tampón de acetato de sodio 0,1M (pH 4,8), y se incubaron a 37°C durante 5min. Posteriormente, se añadieron 100μl de una solución mixta, con un cromógeno y una solución con ion metal de transición en una proporción de 1:25. Luego se incubó a 37°C durante 1min antes de la lectura espectrofotométrica a 505nm durante 12min, a intervalos de 1min. Se construyó automáticamente una curva de calibración a partir de las pendientes, calculadas en función de la absorbancia variable (delta) a 505nm de cada lectura (min), correspondiente a la concentración de peróxido de hidrógeno. El analizador (lector de placas espectrofotométricas) calculó los niveles de ROS en las muestras a partir de la curva de calibración y se expresó en términos de niveles equivalentes de peróxido de hidrógeno (1 unidad = 1,0mg de H2O2/l).
Capacidad antioxidante total (FRAP)
La capacidad antioxidante total se analizó mediante la prueba de poder antioxidante reductor férrico (FRAP) como describió Benzie y Strain (1996), con modificaciones para su uso con células espermáticas. Para este análisis, solo se usó un reactivo de trabajo, que consistía en 300mmol/l de tampón de acetato (pH 3,6), 10mmol/l de 2,4,6-tri-piridil-s-triazina (TPTZ) en 40mmol/l de HCl y 20mmol/l de FeCl3-6H2O en una proporción de 10:1:1. El análisis se realizó en placas de 96 pocillos mezclando 180μl de reactivo de trabajo con 6μl de muestra o estándar (se utilizó como estándares distintas concentraciones de Fe (II). Fe (II) (1000μmol/L) es equivalente a 1000μmol/L de FRAP), e incubando 10min a 37°C, para finalmente realizar la lectura espectrofotométrica a 593nm. El cambio de absorbancia se traduce en un valor FRAP al relacionar el cambio de absorbancia a 593nm de la muestra de prueba con el valor de concentración de una solución estándar de valor FRAP conocido (37,5-2400μmol/l).
Para los análisis de ROS y FRAP, fue necesario un tratamiento previo de los espermatozoides para la liberación de los compuestos intracelulares oxidantes y antioxidantes. A los 30min y 150min, se tomó una alícuota de 100µl de la muestra descongelada (200 millones de espermatozoides) y se homogeneizó con 100µl de solución de PBS (solución salina tamponada con fosfato) con tritón al 0,4% para solubilizar las membranas, incubándolas a temperatura ambiente durante 1h. Después de ese tiempo, se centrifugaron a 3900g y se recuperó el sobrenadante en el cual se realizaron los análisis de ROS y FRAP.
Peroxidación lipídica de la membrana (MDA)
La peroxidación lipídica de la membrana se estimó mediante la generación final de malondialdehído (MDA), determinada por la prueba de ácido tiobarbitúrico (TBA) adaptada para espermatozoides (Roca et al., 2004). Para su determinación, en 1º lugar, se mezclaron 200μl de cada muestra descongelada (250 × 106 espermatozoides/ml) con 1ml de ácido tricloroacético frío al 20% (p/v) para precipitar las proteínas. Las muestras se centrifugaron a 1500g durante 10min y se descartó el precipitado. 200μl de los sobrenadantes se incubaron con 200μl de TBA al 0,67% (p/v) en un baño de agua hirviendo a 100°C durante 10min. A continuación, las muestras se enfriaron con hielo y se realizó una lectura espectrofotométrica a 534nm. Se realizó la curva estándar a partir de los resultados de absorbancia a 534nm, correspondientes a las diferentes concentraciones de 1,1,3,3-tetrametoxipropano (precursor de MDA). Los resultados se expresaron como una concentración simple de MDA (pmol/108 células).
Análisis estadístico
Los análisis estadísticos se realizaron con el programa estadístico SAS versión 9.1. Todos los datos se verificaron previamente para la normalidad (prueba de Shapiro-Wilk). Se utilizó el procedimiento de análisis de varianza del modelo MIXTO (ANOVA) para evaluar los efectos de los distintos tratamientos con antioxidantes (tanto en el medio de enfriamiento-congelación como de descongelación), así como el efecto del tiempo de incubación post-descongelación (30min y 150min) a 37°C, sobre el estado del acrosoma, la viabilidad, motilidad y los parámetros de estrés oxidativo. Estos efectos y sus interacciones se incluyeron como efectos fijos y el verraco como un efecto aleatorio en el modelo mixto. En la prueba de efectos fijos, las interacciones no mostraron un efecto estadísticamente significativo y las medias que se muestran corresponden a cada uno de los efectos por separado en los diferentes parámetros de calidad espermática evaluados.
Cuando el ANOVA reveló un efecto significativo, los valores se compararon mediante la prueba de Tukey-Kramer y se consideraron significativos cuando P era inferior a 0,05. Los resultados se presentan como la media ± ES (error estándar).
Resultados
Los resultados principales de la calidad espermática post-descongelación pueden verse en la Tabla 1. En términos generales, la adicción de antioxidantes tuvo efecto sobre la calidad espermática, pero con resultados diferentes cuando se añadían en los medios de enfriamiento-congelación que en el medio de descongelación. El % de EAI se conserva mejor a los 30min post-descongelación en todos los tratamientos comparado con el control. Pero a los 150min los tratamientos que incluyeron los antioxidantes en los medios de enfriamiento-congelación (tratamientos LEY) son los que mantuvieron las diferencias significativas con el control, y los tratamientos con antioxidantes en el medio de descongelación (tratamientos BTS) mantuvieron valores intermedios.
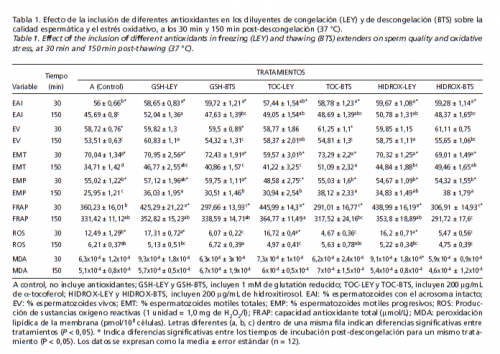
En el % de EV a los 30min no hay diferencias significativas entre ningún tratamiento, pero a los 150min los tratamientos con antioxidantes en los medios de enfriamiento-congelación mostraron diferencias significativas con el control, manteniendo una mayor viabilidad de los espermatozoides en el tiempo, que si los antioxidantes se hubieran incluido en el medio de descongelación.
En el % de EMT a los 30min post-descongelación, no hubo diferencias significativas entre ningún tratamiento (con la excepción del TOC-LEY). Pero a los 150min, la motilidad de todos los tratamientos disminuyó significativamente, siendo el control el que tuvo el % más bajo. Los mejores resultados se observaron en los tratamientos TOC-BTS, HIDROXBTS y GSH-LEY. Por otra parte en el % EMP a los 30min, los tratamientos con glutatión reducido (GSH-LEY y GSH-BTS) mostraron los mejores resultados, pero a los 150min post-descongelación, los resultados se volvieron similares a los observados en los EMT.
Los resultados de ROS, FRAP y MDA se muestran también en la Tabla 1. Los resultados de MDA no mostraron diferencias significativas entre ningún tratamiento ni a los 30min ni a los 150min post-descongelación. Pero si hubo diferencias entre tratamientos en los parámetros de ROS y FRAP, mostrando cómo los tratamientos con antioxidantes en los medios de enfriamiento-congelación a los 30min tienen los valores más altos, y los tratamientos con antioxidantes en el medio de descongelación los más bajos, mostrando valores intermedios el control (P < 0,05). A los 150min, casi todos los tratamientos se equipararon entre sí en estos 2 parámetros.
Discusión
Este estudio muestra que la incorporación de antioxidantes en el proceso de criopreservación espermática de cerdo ibérico, podría proteger la calidad espermática post-descongelación, pero también muestra resultados diferentes cuando los antioxidantes se incorporan en el medio de enfriamiento-congelación que cuando están presentes solo en el medio de descongelación.
Los tratamientos con antioxidantes en los medios de enfriamiento-congelación (tratamientos LEY) mantuvieron más elevados los porcentajes de EV y EAI durante más tiempo. Estudios que han usado estos mismos antioxidantes ha visto también que pueden mejorar la viabilidad espermática en la especie porcina en razas de capa blanca (Gadea et al., 2005a; Jeong et al., 2009; Yeste et al., 2014) o también en otras especies diferentes (Hu et al., 2014; Pei et al., 2018). Incluso algunos autores, en cerdo de capa blanca, han observado al igual que en nuestro estudio que el efecto protector sobre las membranas se observa pasado un tiempo post-descongelación y no poco después de la descongelación (Malo et al., 2010). Muchos de estos autores asumen que la peroxidación lipídica es la causante del mayor porcentaje de espermatozoides con la membrana dañada post-descongelación. Pero en nuestro estudio, los resultados mostraron que la peroxidación, analizada indirectamente por MDA, fue muy baja y sin diferencias entre los tratamientos, y la viabilidad solo se mantuvo en el tiempo cuando los antioxidantes estaban presentes durante la congelación y no así en la descongelación. Por esta razón, el efecto beneficioso de los antioxidantes puede estar más relacionado con su capacidad para estabilizar las membranas (Wang y Quinn, 1999; Khan et al., 2020). Ciertos antioxidantes como el α-tocoferol pueden formar complejos con los componentes lipídicos de la membrana, haciendo que la membrana sea más estable (revisado por Wang y Quinn, 1999). Algunos estudios, en cerdos de capa blanca, han visto cómo los antioxidantes aumentan el porcentaje de espermatozoides con menor desorden lipídico en sus membranas (Peña et al., 2004; Gadea et al., 2005a), y han mostrado también un efecto estabilizador en la estructura de la nucleoproteína (Yeste et al., 2013 y 2014). Así sabiendo que el proceso de crioconservación induce cambios en la membrana de los espermatozoides que conducen a su desestabilización, lo que afecta a la integridad del acrosoma y el desorden lipídico de las membranas (revisado por Yeste, 2015), es posible que la estabilidad durante el enfriamiento y la congelación dada por los antioxidantes, pudiera permitir la existencia de un mayor porcentaje de espermatozoides sin cambios en la estructura de su membrana lipídica y, por lo tanto, una mejor resistencia contra el proceso de crioconservación. Esto explicaría porque no se mantiene la vialidad y la acrosomía igual cuando los antioxidantes están en el medio de enfriamiento-congelación que en el de descongelación.
La motilidad en términos generales a los 30min (EMT y EMP) no se vio influenciada por la presencia de antioxidantes en el medio de congelación o descongelación. Esto se asemeja a lo observado en otros estudios en cerdos de otras razas, donde la motilidad tampoco se vio afectada por los antioxidantes justo después de la descongelación (Gadea et al., 2005a,b; Malo et al., 2010; Arando et al., 2019). Cabe remarcar que los tratamientos que incluían glutatión reducido (GSH-LEY y GSH-BTS), mostraron valores significativamente más altos de EMP que otros tratamientos y, resultados similares han sido observados en otros estudios en la especie porcina, donde usaron este antioxidante (Yeste et al., 2014; Giaretta et al., 2015). Por otro lado, el tratamiento TOC-LEY fue el único que mostró valores más bajos de EMT, hecho que podría ser debido al tipo de α-tocoferol utilizado, ya que mostró más problemas para su dilución en el medio LEY.
Aunque se ha descrito una disminución en la formación de MDA debido a la presencia de antioxidantes en el proceso de congelación espermática (Hu et al., 2014; Pei et al., 2018), en este estudio se ha observado que no existen diferencias significativas en su formación entre tratamientos, siendo además los valores muy bajos, lo que concuerda con estudios similares, en distintas especies, donde el porcentaje de espermatozoides peroxidados eran muy bajos (Guthrie y Welch, 2007; Gómez-Férnandez et al., 2013; Arando et al., 2019).
Además, nuestro estudio muestra resultados muy diferentes en la capacidad antioxidante total y la producción de ROS cuando el antioxidante se encuentra en el medio de congelación o en el de descongelación a los 30min post-descongelación. Esto podría ser debido al propio equilibrio redox espermático. Estudios recientes han determinado (Panner Selvam et al., 2018) que medir el potencial de reducción oxidativa, que en esencia mide el potencial resultante entre todas las moléculas oxidativas y todas las moléculas reductoras, podría permitir medir el estrés oxidativo de manera más fiable. Y es que la mayoría de los trabajos se centran en analizar la producción de ROS o la peroxidación lipídica, sin tener en cuenta si existe o no un desequilibrio. El estrés oxidativo ocurre cuando el equilibrio entre la oxidación y los sistemas antioxidantes se interrumpe debido a los niveles excesivos de ROS o al agotamiento de los antioxidantes, por lo tanto, para evaluar adecuadamente el nivel de estrés oxidativo, estos marcadores deben interpretarse juntos (de Mercado et al., 2018). En este estudio se intentó observar, si variaciones en la producción de sustancias ROS irían acompañadas también de variaciones en la capacidad antioxidante (medido por FRAP), observando así si hay una descompensación con respecto al control. Así, observando los resultados, el punto de mayor desequilibrio redox podría ser el momento de la descongelación. En el control los valores de ROS son altos, pero no es así en los tratamientos con antioxidantes en el medio de descongelación. Es posible que la presencia de estos antioxidantes en el diluyente de descongelación ayude a prevenir la formación temprana de ROS, que no ocurre en la muestra control. En consecuencia, la menor producción de ROS disminuye la respuesta antioxidante, y por eso estos tratamientos tienen valores de FRAP más bajos. Al observar los resultados en los tratamientos con antioxidantes en los medios de enfriamiento-congelación, se observaron niveles más altos de ROS que el control. Esto puede deberse a que, durante la descongelación, el momento de mayor desequilibrio redox, las muestras se diluyen en BTS 1:1 (sin ningún antioxidante para estos tratamientos), lo que provoca que su capacidad antioxidante se reduzca bruscamente a la mitad; esto causaría el mayor incremento de ROS observado en los resultados y, en consecuencia, el aumento de la capacidad antioxidante (FRAP) como respuesta compensatoria. Con el tiempo (150min post-descongelación), los valores de ROS y FRAP se equiparán entre todos los tratamientos, posiblemente debido a que el estrés oxidativo del momento inicial de la descongelación ha ido disminuyendo y por tanto todos los valores se van equilibrado. Esto mostraría que el momento de descongelación podría ser un punto clave del posible desequilibrio redox.
Todos estos resultados concuerdan con estudios anteriores que sugieren que el sistema endógeno de defensa frente a sustancias ROS en el esperma de cerdo es suficientemente eficiente para proteger las células durante el proceso de criopreservación (Guthrie et al., 2008), y con estudios que han demostrado que los niveles de espermatozoides peroxidados son extremadamente bajos (Guthrie y Welch, 2007; Gómez-Fernández et al., 2013; Arando et al., 2019). Por lo tanto, esto podría sugerir que la peroxidación lipídica no es uno de los principales factores responsables de la disfunción espermática en la especie porcina atribuida a la criopreservación (Parrilla et al., 2012).
Conclusiones
Este estudio muestra que el uso de antioxidantes en el medio de enfriamiento-congelación puede mejorar la criopreservación espermática de cerdo ibérico, especialmente la inclusión de glutatión reducido (1mM), facilitando la implementación del uso del semen congelado en la inseminación artificial en cerdo ibérico. Por otro lado, en el caso de muestras espermáticas ya congeladas en, por ejemplo, bancos de recursos zoogenéticos, sería interesante la inclusión de antioxidantes en el medio de descongelación, por ser capaces de mantener la motilidad espermática post-descongelación durante más tiempo. Aun así, serían necesarios más estudios para determinar si otras concentraciones u otros antioxidantes pudieran funcionar mejor en esta raza porcina, y también profundizar en su efecto sobre el equilibrio redox.
Autores
Lucía Arranz-Virseda, Cristina Tomás-Almenar, Juan José Ciruelos, Emilio Gómez-Izquierdo y Eduardo de Mercado. Subdirección de Investigación y Tecnología, Instituto Tecnológico Agrio de Castilla y León, Consejería de Agricultura y Ganadería, Hontalbilla, Segovia, España.
Referencias bibliográficas
- Arando A, Delgado JV, Fernández-Prior A, León JM, Bermúdez-Oria A, Nogales S, Pérez-Marín CC (2019). Effect of different olive oil-derived antioxidants (hydroxytyrosol and 3,4-dihydroxyphenylglycol) on the quality of frozenthawed ram sperm. Cryobiology 86: 33-39.
- Awda BJ, Mackenzie-Bell M, Buhr MM (2009). Reactive oxygen species and boar sperm function. Biology of Reproduction 81: 553-561.
- Barranco I, Tvarijonaviciute A, Perez-Patiño C, Parrilla I, Ceron JJ, Martinez EA, Rodriguez-Martinez H, Roca J (2015). High total antioxidant capacity of the porcine seminal plasma (SP-TAC) relates to sperm survival and fertility. Scientific Reports 5: 18538.
- Benzie I, Strain J (1996). The ferric reducing ability of plasma (FRAP) as a measure of antioxidant power. The FRAP assay. Analytical Biochemistry 239: 70-76.
- Breininger E, Descalzo A, Rossetti L, Abramovich D, Beconi MT (2011). Boar sperm functionality is related to α-tocopherol content after freezing-thawing. Andrologia 43: 409-415.
- Cremades T, Roca J, Rodriguez-Martinez H, Abaigar T, Vazquez JM, Martinez EA (2005). Kinematic changes during the cryopreservation of boar spermatozoa. Journal of Andrology 26: 610-618.
- De Mercado E, Rodríguez A, Gómez E, Sanz E (2010). Cryopreservation of Iberian pig spermatozoa. Comparison of different freezing extenders based on post-thaw sperm quality. Animal Reproduction Science 118: 54-61.
- De Mercado E, Tomás C, Gómez-Fernández J, Gómez-Izquierdo E, González-Bulnes A, Sánchez-Sánchez R (2011). Estudio de la composición de ácidos grasos de la membrana del espermatozoide de cerdo ibérico y su posible relación con la resistencia al proceso de crioconservación. XIV Jornadas Sobre Producción Animal, 17-18 mayo 2011, Zaragoza, España, pp. 401-403.
- De Mercado E, Larrán AM, Pinedo J, Tomás-Almenar C (2018). Skin mucous: A new approach to assess stress in rainbow trout. Aquaculture 484: 90-97.
- Gadani B, Bucci D, Spinaci M, Tamanini C, Galeati G (2017). Resveratrol and Epigallocatechin-3-gallate addition to thawed boar sperm improves in vitro fertilization. Theriogenology 90: 88-93.
- Gadea J, Sellés E, Marco MA, Coy P, Matás C, Romar R, Ruíz S (2004). Decrease in glutathione content in boar sperm after cryopreservation. Effect of the addition of reduced glutathione to the freezing and thawing extender. Theriogenology 62: 690-701.
- Gadea J, García-Vazquez F, Matás C, Gardón JC, Cánovas S, Gumbao D (2005a). Cooling and freezing of boar spermatozoa: supplementation of the freezing media with reduced glutathione preserves sperm function. Journal of Andrology 26: 396-404.
- Gadea J, Gumbao D, Matás C, Romar R (2005b). Supplementation of the thawing media with reduced glutathione improves function and the in vitro fertilizing ability of boar spermatozoa after cryopreservation. Journal of Andrology 26: 749-756.
- Giaretta E, Estrada E, Bucci D, Spinaci M, Rodríguez-Gil JE, Yeste M (2015). Combining reduced glutathione and ascorbic acid has supplementary beneficial effects on boar sperm cryotolerance. Theriogenology 83: 399-407.
- Gómez-Fernández J, Gómez-Izquierdo E, Tomás C, Mocé E, de Mercado E (2013). Is sperm freezability related to the post-thaw lipid peroxidation and the formation of reactive oxygen species in boars? Reproduction in Domestic Animals 48: 177-182.
- Guthrie HD, Welch GR (2007). Use of fluorescence-activated flow cytometry to determine membrane lipid peroxidation during hypothermic liquid storage and freeze-thawing of viable boar sperm loaded with 4, 4-difluoro-5-(4-phenyl-1,3 butadienyl)-4-bora-3a,4a-diaza-s-indacene-3-undecanoic acid. Journal of Animal Science 85: 1402-1411.
- Guthrie HD, Welch GR, Long, JA (2008). Mitochondrial function and reactive oxygen species action in relation to boar motility. Theriogenology 70: 1209-1215.
- Hayashi I, Morishita Y, Imai K, Nakamura M, Nakachi M, Hayashi T (2007). High throughput spectrophotometric assay of reactive oxygen species in serum. Mutation Research 631: 55-61.
- Hu J, Geng G, Li Q, Sun X, Cao H, Liu Y (2014). Effects of alginate on frozen-thawed boar spermatozoa quality, lipid peroxidation and antioxidant enzymes activities. Animal Reproduction Science 147: 112-118.
- Jeong YJ, Kim MK, Song HJ, Kang EJ, Ock SA, Kumar BM, Balasubramanian S, Rho GJ (2009). Effect of alpha-tocopherol supplementation during boar semen cryopreservation on sperm characteristics and expression of apoptosis related genes. Cryobiology 58: 181-189.
- Johnson LA, Weitze KF, Fiser P, Maxwell WMC (2000). Storage of boar semen. Animal Reproduction Science 62: 143-172.
- Kedechi, S, Zribi N, Louati N, Menif H, Sellami A, Lassoued S, Ben Mansour R, Keskes L, Rebai T, Chakroun N (2016). Antioxidant effect of hydroxytyrosol on human sperm quality during in vitro incubation. Andrologia 49(1): e12595.
- Khan M, Samrana S, Zhang Y, Malik Z, Daud Khan M, Zhu S (2020). Reduced glutathione protects subcellular compartments from Pb-Induced ROS injury in leaves and roots of upland cotton (Gossypium hirsutum L.). Frontiers in Plant Science 11: 412.
- Maldjian A, Pizzi F, Gliozzi TM, Cerolini S, Penny P, Noble R (2005). Changes in sperm quality and lipid composition during cryopreservation of boar semen. Theriogenology 63: 411-421.
- Malo C, Gil L, Gonzalez N, Martínez F, Cano R, de Blas I, Espinosa E (2010). Anti-oxidant supplementation improves boar sperm characteristics and fertility after cryopreservation: comparison between cysteine and rosemary (Rosmarinus officinalis). Cryobiology 61: 142-147.
- MAPA (2019). Ministerio de Agricultura Pesca y Alimentación. Censos de animales y productos comercializados.
- Panner Selvam MK, Henkel R, Sharma R, Agarwal A (2018). Calibration of Redox potential in sperm wash media and evaluation of oxidation-reduction potential values in various assisted reproductive technology culture media using MiOXSYS system. Andrology 6: 293-300.
- Parrilla I, del Olmo D, Sijses L, Martinez-Alborcia MJ, Cuello C, Vazquez JM, Martinez EA Roca J (2012). Differences in the ability of spermatozoa from individual boar ejaculates to withstand different semen-processing techniques. Animal Reproduction Science 132: 66-73.
- Pei Y, Yang L, Wu L, He H, Geng G, Xu D, Chen H, Li Q (2018). Combined effect of apigenin and ferulic acid on frozen-thawed boar sperm quality. Animal Science Journal 89: 956-965.
- Peña FJ, Johannisson A, Wallgren M, Rodriguez-Martinez H (2004). Antioxidant supplementation of boar spermatozoa from different fractions of the ejaculate improves cryopreservation: changes in sperm membrane lipid architecture. Zygote 12: 117-124.
- Pursel VG, Johnson LA, Schulman LL (1972). Interaction of extender composition and incubation period on cold shock susceptibility of boar spermatozoa. Journal of Animal Science 35: 580-584.
- Pursel VG, Johnson LA (1975). Freezing of boar spermatozoa: fertilizing capacity with concentrated semen and a new thawing procedure. Journal of Animal Science 40: 99-102.
- Herrero-Medrano JM, Megens H, Groenen MAM, Ramis G, Bosse M, Pérez-Enciso M, Crooijmans RPMA (2013). Conservation genomic analysis of domestic and wild pig populations from the Iberian Peninsula. BMC Genet 14: 106.
- Roca J, Gil MA, Hernandez M, Parrilla I, Vazquez JM, Martinez EA (2004). Survival and fertility of boar spermatozoa after freeze-thawing in extender supplemented with butylated hydroxytoluene. Journal of Andrology 25: 397-405.
- Tomás C, Gómez-Fernández J, Gómez-Izquierdo E, de Mercado E (2014). Combined use of fluorescence and phase contrast microscopy for the determination of sperm viability. Reproduction in Domestic Animals 49: 103.
- Tripoli E, Giammanco M, Tabacchi G, Di Majo D, Giammanco S, La Guardia M (2005). The phenolic compounds of olive oil: structure, biological activity and beneficial effects on human health. Nutrition Research Reviews 18: 98-112.
- Wang X, Quinn PJ (1999). Vitamin E and its function in membranes. Progress in Lipid Research 38: 309-336.
- Watson PF (1995). Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reproduction Fertility and Development 7(4): 871-891.
- Weng XG, Cai MM, Zhang YT, Liu Y, Gao ZL, Song J, Liu ZH (2018). Effect of Astragalus polysaccharide addition to thawed boar sperm on in vitro fertilization and embryo development. Theriogenology 121: 21-26.
- Yeste M, Flores E, Estrada E, Bonet S, Rigau T, Rodríguez-Gil JE (2013). Reduced glutathione and procaine hydrochloride protect the nucleoprotein structure of boar spermatozoa during freeze-thawing by stabilising disulfide bonds. Reproduction, Fertility and Development 25: 1036-1050.
- Yeste M, Estrada E, Pinart E, Bonet S, Miró J, Rodríguez-Gil JE (2014). The improving effect of reduced glutathione on boar sperm cryotolerance is related with the intrinsic ejaculate freezability. Cryobiology 68: 251-261.
- Yeste M (2015). Recent advances in boar sperm cryopreservation: state of the art and current perspectives. Reproduction in Domestic Animals 50: 71-79.
- Yeste M (2017). State-of-the-art of boar sperm preservation in liquid and frozen state. Animal Reproduction 14: 69-81.


Deja un comentario