Los trastornos posparto en las cerdas representan un complejo de enfermedades económicamente importante en la producción moderna de lechones en todo el mundo. Los posibles hallazgos que afecten a las glándulas mamarias y/o al aparato reproductor y al estado general de la cerda se resumen en un síndrome consistente en un conjunto de síntomas como mastitis y/o metritis. El término síndrome de disgalactia posparto (PDS) es el más utilizado (Klopfenstein et al., 2006), pero existen otros nombres como mastitis-metritis-agalactia (MMA) (Martin, et al, 1967), agalactia toxemica (Ringarp, 1960), complejo de agalactia (Penny, 1970), agalactia posparto (Hermannson, et al., 1978), fracaso de la lactancia (Elmore y Martin, 1980), el síndrome de hipogalactia periparto (Smith et al., 1992) o la septicemia y toxemia puerperal (Bostedt et al., 1998) también se han sugerido. El síntoma predominante es la reducción de la producción de leche con o sin mastitis aparente durante los primeros días después del parto (Ross et al., 1981; Wegmann et al., 1986; Heinritzi y Hagn, 1999). El aumento de las pérdidas de lechones debido a las altas tasas de mortalidad causadas por la falta de suficiente producción de leche conduce a un número significativamente reducido de lechones destetados. Las posibles causas del SDP varían, y la etiología del síndrome es claramente multifactorial (Gerjets and Kemper, 2009). En la mayoría de los casos, el PDS se limita a unos pocos animales y puede ser solo esporádico.
No obstante, se describieron casos casi epidémicos en hatos afectados con una incidencia documentada en hatos de cerdas de hasta el 60% (Hirsch et al., 2004). La incidencia media de los mismos se describió en aproximadamente un 13% (Hermannson et al., 1978; Jorsal, 1983; Bäckström et al., 1984; Madec y Leon, 1992; Papadopoulos et al., 2008a). Sin embargo, estos estudios epidemiológicos sobre la incidencia a nivel de rebaño no son directamente comparables debido a las diferentes definiciones de rasgos de PDS sin un fenotipo definido en común. Las cerdas en rebaños con diferentes prácticas y estándares de higiene pueden mostrar PDS. Incluso ocurre en granjas excelentemente administradas con prácticas de desinfección optimizadas. La mayor parte de la investigación sobre este tema se llevó a cabo entre las décadas de 1970 y 1990 (Gerjets y Kemper, 2009).
A pesar de las continuas actividades de investigación, no se ha hecho ningún avance real y no se ha identificado ninguna vía única. Esto confirma la etiología multifactorial o indica que, si hay una sola vía, puede estar enmascarada por otros factores superpuestos. Ambos pueden esperarse en un síndrome definido como un conjunto de síntomas. Sin embargo, el PDS todavía se diagnostica regularmente en las granjas. En la práctica, la mayoría de los casos clínicos pueden tratarse eficazmente con antiinflamatorios, hormonas o antibióticos. Sin embargo, debido a la creciente necesidad del uso prudente de antimicrobianos en la última década, se ha vuelto necesaria una mirada más detallada a la etiología y posible prevención del SDP. Dado que los signos clínicos son tan variados como las etiologías posibles, esta revisión tiene como objetivo resumir los conocimientos recientes sobre el PDS adquiridos en la última década.
ETIOLOGÍA
Un modelo teórico ampliamente aceptado de etiopatogenia del PDS es que las bacterias del entorno de las cerdas infectan la glándula mamaria por vía galactógena o endógena. A través de la vía galactógena, las bacterias pueden entrar en el conducto del pezón y los 2 sistemas de glándulas detrás de él, cuyos orificios, a diferencia de los de las vacas, no están cerrados por esfínteres musculares (Klopfenstein et al., 2006). Varios experimentos confirman esta hipótesis de una ruta de infección galactógena y muestran una reducción en la incidencia de mastitis después de proteger las glándulas mamarias contra la contaminación fecal (Middleton Williams et al., 1977; Bertschinger et al., 1990). En un entorno experimental, se determinó que el momento de la infección galactógena ocurre en más del 50% de los casos antes del nacimiento, pero solo antes del día 108 de gestación y luego, nuevamente, en los primeros 2 días después del parto (Bertschinger et al., 1990). En experimentos de infección inoculando con Escherichia coli a cerdas intramamariamente para provocar mastitis, la dosis de infección fue muy baja con menos de 100 bacterias (Österlundh et al., 2002). Con respecto a la ruta endógena de infección, se planteó la hipótesis de que las bacterias colonizan la glándula mamaria después de atravesar las barreras en el intestino o el útero. Sin embargo, el origen uterino de las bacterias aisladas de la glándula mamaria no parece probable. De hecho, en un estudio previo que comparó la flora bacteriana en diferentes secciones del intestino, el útero y la glándula mamaria, las bacterias Gram negativas solo se aislaron de esta última y del íleon (Morkoc et al., 1983). Estos hallazgos están respaldados por estudios anteriores (Armstrong et al., 1968; Bertschinger et al., 1977a). Se ha aislado una variedad de especies bacterianas de la leche de cerdas afectadas por SDP y su contribución a la etiología ha sido objeto de un debate controvertido (Awad Masalmeh et al., 1990; Kobera, 2000; Kemper et al., 2013). Las bacterias de los géneros bacterianos Escherichia, Citrobacter, Enterobacter y Klebsiella, pertenecientes a la clase de coliformes, fueron las especies más frecuentemente aisladas de cerdas afectadas por mastitis (Ross et al., 1981; Awad Masalmeh et al., 1990; Hirsch et al., 2003; Angjelovski et al., 2016). Los experimentos de infección demostraron el papel de estas bacterias en la etiología de la mastitis de las cerdas (Bertschinger et al., 1977b; Ross et al., 1981; Wegmann y Bertschinger, 1984; Pedersen Mörner et al., 1998; Österlundh et al., 2002). Sin embargo, otras especies, como Streptococcus spp., Staphylococcus spp., Pseudomonas spp., Clostridium spp., Proteus spp. o Corynebacterium spp., también se aislaron de muestras de leche de cerdas enfermas (Baer y Bilkei, 2005; Angjelovski et al., 2016). Como se analiza en detalle más adelante, en la sección sobre las bacterias como factor influyente, la determinación exacta del papel de las bacterias en la patogenia es un desafío.
En 1º lugar, también se aislaron bacterias en el calostro y la leche de cerdas que no mostraban signos de PDS clínico (Preissler y Kemper, 2011; Kemper et al., 2013; Angjelovski et al., 2016) y, en 2º lugar, no todas las cerdas que fueron inoculadas con cantidades definidas de cepas infecciosas desarrollaron PDS clínico en experimentos de infección (Österlundh et al., 1998). Esto indica que, aunque las bacterias causan inflamación, el desarrollo de SDP también está relacionado con otros factores. En un comentario reciente, se sugirió definir PDS como “mastitis coliforme subclínica”, similar a la mastitis coliforme en vacas, y aprovechar esta similitud en enfoques de investigación adicionales (Pospischil y Bertschinger, 2018).
Otra hipótesis para la etiología del PDS es la participación de las endotoxinas de los lipopolisacáridos (LPS) que desencadenan varios mediadores endógenos que provocan una fuerte reacción patológica en las cerdas (Elmore et al., 1978). Como una parte importante de la membrana externa de las bacterias Gram-negativas, especialmente aquellas ubicadas en el intestino, los LPS se liberan cuando estas bacterias se descomponen. Muestran un fuerte efecto sistémico sobre el estado general, pero en lo que respecta al PDS, su impacto en la regulación hormonal de la secreción de calostro y leche es de especial importancia; ya en 1985, Smith y Wagner (1984) mostraron que LPS suprime la liberación de prolactina por la hipófisis anterior. De esta manera, la concentración de cortisol aumenta y la hormona tiroidea circulante disminuye, lo que resulta en una disminución de la producción y secreción de leche (Smith y Wagner, 1984; Reiner et al., 2009). Después de la administración experimental de LPS por vía intravenosa, subcutánea, intramamaria o a través del útero, se observaron cambios clínicos y químicos en la sangre similares a los casos de PDS en granjas (Nachreiner y Ginther, 1974; Elmore et al., 1978).
Resumiendo aquí los factores de riesgo conocidos y colocándolos en un nuevo contexto, a saber, la homeorhesis, (Martineau et al., 2013) propusieron que el enfoque clínico del SDP también debe considerar la fisiología, la endocrinología, la inmunología innata y la etología en el momento crítico del parto con el cambio crítico del estado anabólico al catabólico. Los primeros estudios que compararon las alteraciones hormonales y metabólicas en cerdas sanas y afectadas por PDS cada 14h en el período de 60h antes a 36h después del parto, mostraron diferencias significativas en varias de las hormonas examinadas e indicadores metabólicos antes del nacimiento, lo que indica un desequilibrio en animales enfermos posteriores (Kaiser et al., 2018a, 2018b), apoyando la teoría de Martineau et al. (2013). Esto parece ser cierto especialmente en las cerdas hiperprolíficas modernas, con camadas grandes y duraciones de parto más prolongadas (Peltoniemi, et al., 2016), y las posibles relaciones con el desarrollo de PDS deben investigarse en futuras investigaciones.
LECHONES AFECTADOS POR CERDAS ENFERMAS
Aunque el PDS es principalmente una enfermedad que ocurre en las cerdas, principalmente los lechones sufren como consecuencia debido al acceso restringido a la leche. Por lo tanto, el PDS afecta la salud y el bienestar tanto de las cerdas como de los lechones.
En las primeras semanas de vida, el acceso al calostro y la leche es vital, y los lechones dependen totalmente de la cerda. El rendimiento y la composición de la leche son factores críticos para determinar la tasa de crecimiento en los lechones lactantes (Gruen et al., 1993). Las cerdas afectadas por PDS no satisfacen las necesidades de sus lechones debido a la disgalactia en combinación con un aumento del dolor en la glándula mamaria. Las cerdas afectadas tienden a acostarse sobre sus glándulas mamarias, por lo que niegan a los lechones el acceso a sus dolorosas tetinas. La falta de suministro de leche conduce a una mayor tasa de mortalidad y retraso en el crecimiento de los lechones (Ringarp, 1960; Penny, 1970). La combinación de lechones débiles y desabastecidos, y la mayor tendencia de la cerda a acostarse en decúbito lateral, conduce a una mayor incidencia de aplastamiento (Hellbrügge et al., 2008). En camadas de cerdas afectadas por PDS, se informó que la mortalidad de los lechones dentro de la 1ª semana posparto aumentó en un 5% (Hühn y Rehbock, 1999) hasta un 38,6% (Bäckström et al., 1984).
Como el PDS se caracteriza por la ocurrencia de producción de leche reducida durante los primeros días después del parto, es obvio que el período de calostro, dentro de las primeras 24 h después del nacimiento (Farmer et al., 2019), se ve afectado. La especial importancia de una ingesta suficiente de calostro en lechones recién nacidos ha sido bien establecida. Para la supervivencia de los lechones, los primeros días después del nacimiento son el período más crítico, y la ingesta inadecuada de calostro es la causa subyacente de la mayoría de las muertes de lechones durante este período (Quesnel et al., 2012). Es esencial llenar las reservas bajas de glucógeno en lechones recién nacidos, porque no pueden realizar suficiente gluconeogénesis, y la rápida disminución de glucógeno puede inducir hipoglucemia (Farmer et al., 2019). Además de su contenido energético, el calostro es esencial para el desarrollo saludable de los lechones debido a la transferencia materna de inmunoglobulinas y linfocitos (Chase y Lunney, 2019). En 1º lugar, la ingesta inadecuada de calostro puede provocar inanición, crecimiento deficiente e incluso la muerte por inanición e hipotermia. En 2º lugar, también puede dar lugar a infecciones secundarias como la diarrea si los lechones no están protegidos por anticuerpos maternos (Rooke y Bland, 2002).
Incluso en circunstancias sin evidencia de PDS en una piara de cerdas, el suministro de leche, y especialmente de calostro, puede ser crítico en cerdas hiperprolíficas. Se demostró que, con el aumento del tamaño de las camadas en las últimas décadas, la producción de leche también ha aumentado. Sin embargo, esto no es proporcional al número de lechones (Prunier et al., 2010). Aún más importante, el aumento del tamaño de las camadas conduce a una disminución de la cantidad de calostro por lechón en las cerdas hiperprolíficas modernas (Devillers et al., 2007). Como los estudios citados se realizaron hace unos 10 años, se puede suponer que las proporciones podrían ser peores hoy, pero esto requiere una verificación adicional. Sin embargo, está claro que esta situación se agrava con la aparición de PDS.
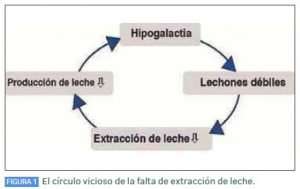
En este contexto, el círculo vicioso de la falta de extracción de leche (Figura 1) empeora la situación. Solo se reproduce la leche extraída por los lechones, y solo los cerdos vitales y sanos son capaces de amamantar adecuadamente a una cerda sana que les permite hacerlo. Si la voluntad de la cerda y su capacidad para proporcionar suficiente leche se ven afectadas, los lechones se vuelven más débiles y amamantan aún menos, lo que puede resultar no solo en hipogalactia sino también en agalactia. Para romper este círculo vicioso, no solo hay que estimular de nuevo la lactancia, sino que también es fundamental una adecuada provisión de los cerdos para asegurar su vitalidad.
DIAGNÓSTICO
Los principales signos clínicos del PDS en cerdas son mastitis, disgalactia y fiebre superior a 39,5°C en cerdas dentro de las 12 a 48h posteriores al parto (Furniss, 1987; Gerjets y Kemper, 2009). Sin embargo, debido a un cuadro clínico muy variable, el diagnóstico puede ser difícil. La práctica más común para el diagnóstico precoz en granjas comerciales es medir la temperatura rectal después del parto. Sin embargo, esto debe realizarse idealmente en combinación con un examen de los cambios en las glándulas mamarias y la consideración de signos de disminución de la producción de leche o reducción del apetito. El rango de umbrales críticos de temperatura varía entre 39,3°C y 40,5° C (Waldmann y Wendt, 2001), y el tratamiento, principalmente con antibióticos, se administra tan pronto como se superan estos umbrales. Sin embargo, a menudo se observa hipertermia fisiológica en cerdas posparto, especialmente en primerizas, lo que lleva a interpretaciones erróneas (Klopfenstein et al., 2006; Gerjets et al., 2008; Stiehler et al., 2015). Stiehler et al. (2015) enfatizan que la medición de la temperatura debe estandarizarse y medirse a la misma hora del día.
La investigación de las glándulas mamarias, y especialmente de los cambios de comportamiento en cerdas y lechones, permite un diagnóstico más preciso. Las glándulas mamarias pueden parecer normales o patológicamente alteradas, variando desde hinchadas, firmes y calientes al tacto hasta cambios de color. Los cambios pueden estar limitados a unos pocos pezones con localización variable o generalizados. En cuanto a la ubicación de las glándulas mamarias afectadas, las glándulas abdominales son más propensas a cambios patológicos en comparación con las pectorales (Baer y Bilkei, 2005). Otro criterio relacionado con un alto riesgo de desarrollar SDP puede ser cualquier signo de estreñimiento, como heces sólidas y secas, o no defecar en absoluto (Pendl et al., 2017).
Como ya se ha comentado, el comportamiento de las cerdas puede verse alterado en cuanto a su estado general y su voluntad de permitir el acceso de los lechones a la ubre tumbadas permanentemente. Los pezones pueden traumatizarse y mostrar lesiones superficiales o más profundas provocadas por los lechones en su deseo de leche después de arduos esfuerzos de lactancia. Por un lado, los cambios de comportamiento en las cerdas deben ser considerados en el diagnóstico; por otro lado, el comportamiento llamativo de los lechones puede dar indicios de que las cerdas desarrollan PDS. Por ejemplo, se pueden notar vigorosos esfuerzos de enfermería. La eyección de leche reducida o ausente conduce a una disminución de los intervalos de lactancia y un aumento en la actividad de los lechones, a menudo con un comportamiento agonístico, seguido también de lesiones en la piel (Prunier et al., 2010). Posteriormente, con la disminución de las reservas de energía, el intento de mamar de los lechones se debilita y, a menudo, se retiran a las partes más cálidas del corral de parto y muestran signos de comportamiento de aislamiento (Klopfenstein et al., 2006). Además, intentan ingerir otros líquidos que, en combinación con la falta de calostro, pueden causar diarrea (Sărăndan et al., 2009).
Como la medida de la temperatura corporal es inespecífica, indicando un aumento únicamente alteraciones en el estado fisiológico de los animales de sangre caliente, y los demás factores conductuales antes mencionados indicativos de SDP no necesariamente se valoran en la explotación, se puede suponer que un porcentaje importante de El PDS está mal diagnosticado. Por tanto, se debe hacer especial hincapié en diagnosticar correctamente el SDP.
Otro enfoque de diagnóstico clínico fue el uso de la ultrasonografía como medida de precaución para diferenciar cerdas que habían sufrido SDP recurrente y que mostraban imágenes hiperecogénicas de animales sanos (Baer y Bilkei, 2005). Sin embargo, no se ha implementado en el manejo de cerdas debido a costos adicionales y manejo poco práctico.
En cambio, se han propuesto una serie de indicadores de laboratorio para diagnosticar el SDP con mayor precisión (Mirko y Bilkei, 2004; Zhu et al., 2004, 2007a, 2007b). Sin embargo, estos no se han puesto en práctica en las fincas por diferentes motivos. Todos los enfoques para diagnosticar el SDP basados en cambios en la sangre, ya sean marcadores inflamatorios u hormonas, no son factibles en las granjas porque la toma de muestras de sangre es mucho más laboriosa que medir la temperatura corporal de las cerdas. Estas limitaciones prácticas también son válidas para los intentos de diagnosticar el SDP según los parámetros modificados en la orina de las cerdas enfermas (Petersen, 1983; Papadopoulos et al., 2008b), o en su leche. Paralelamente al uso de indicadores de mastitis en la leche de vaca, se sugirieron como indicadores el conteo de células (Persson et al., 1996) y el pH de la leche (Waldmann y Wendt, 2001). No obstante, debido a las dificultades para obtener cantidades adecuadas de leche de las cerdas en la práctica, su uso también es muy limitado. Además de los problemas para adquirir material de muestra adecuado, otra deficiencia de los parámetros sugeridos es la información no específica que proporcionan. Por ejemplo, de forma similar a la fiebre, los niveles de concentración plasmática de proteínas de fase aguda aumentan en situaciones estresantes como el PDS y, por lo tanto, se informó que cambiaban en las cerdas enfermas (Mirko y Bilkei, 2004). Sin embargo, estos niveles son inespecíficos y también pueden, como la fiebre, variar sustancialmente alrededor del nacimiento (Magnusson y Fossum, 1992). Más recientemente, se ha propuesto la saliva como una matriz prometedora para identificar cerdas afectadas por PDS en una etapa temprana, con concentraciones aumentadas de cromogranina A salival y cortisol en los animales afectados (Kaiser et al., 2018b). Además, se demostró que el 8-epi-PGF2 sérico aumentaba en las cerdas afectadas por PDS antes del parto, lo que indica estrés oxidativo (Kaiser et al., 2018b).
Todas estas restricciones de parámetros diagnósticos alternativos ilustran la importancia de monitorear cuidadosamente a las cerdas y sus lechones después del parto, registrando cualquier cambio en su comportamiento para diagnosticar correctamente los casos reales de PDS.
FACTORES DE INFLUENCIA
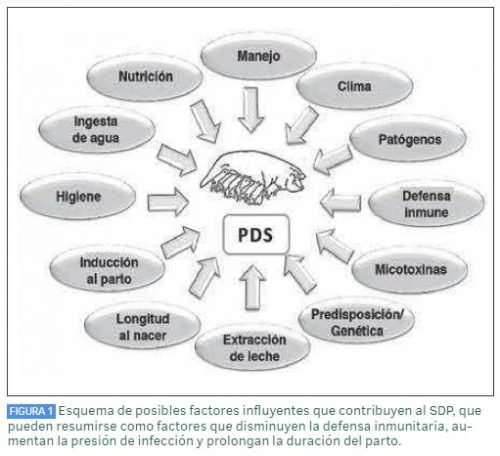
Los factores que se ha demostrado que influyen en el desarrollo clínico del SDP son numerosos y se resumen en Figura 2. En la investigación, el PDS ha sido solo un problema menor en los últimos años en los artículos de investigación publicados. Esto puede estar relacionado con el hecho de que, con su etiología multifactorial, lo más probable es que no solo una única vía sea responsable del resultado de la enfermedad o, si una única vía, hasta ahora no identificada, es relevante, podría estar enmascarada por otros factores influyentes. Por lo tanto, hasta ahora, los factores individuales se pueden clasificar en aquellos que disminuyen la defensa inmunitaria, aumentan la presión de infección o prolongan la duración del parto. A continuación, se aclaran con más detalle los factores “bacterias”, “cría y manejo” y “predisposición de las cerdas”.
BACTERIAS
Las bacterias aisladas de la leche de las cerdas sólo tienen valor informativo en combinación con el cuadro clínico. La presencia de bacterias en la leche de las cerdas por sí sola no conduce a signos clínicos, y en las muestras de leche de cerdas sanas, se pueden encontrar regularmente varias bacterias (Kemper et al., 2013; Angjelovski et al., 2016). Una razón puede ser el conducto del pezón relativamente abierto con bacterias posiblemente ascendentes del entorno de la cerda. La otra razón podría estar relacionada con el procedimiento de muestreo, porque ordeñar una cerda después de las primeras horas después del parto es casi fácil y, a menudo, solo se puede realizar después de la inyección de oxitocina. Todo el procedimiento puede provocar contaminación y resultados falsos positivos.
Escherichia coli es el patógeno que se aísla con mayor frecuencia en asociación con PDS (Armstrong et al., 1968; Ross et al., 1981; Awad Masalmeh et al., 1990). Otros estudios sobre los perfiles de virulencia de E. coli no revelaron diferencias en la prevalencia o en perfiles genéticos de virulencia específicos de aislamientos de cerdas sanas o enfermas (Gerjets et al., 2011b). En este estudio, se detectó una variedad de genes de virulencia en aislados de E. coli tanto de cerdas positivas como negativas para PDS, y la mayoría de los genes de virulencia pertenecen al gran grupo de genes relacionados con Escherichia coli patógena extraintestinal (ExPEC). Sin embargo, no fue posible una categorización en el patotipo ExPEC solo por tipificación del gen de virulencia (Gerjets et al., 2011b). No existe una única cepa de E. coli que cause SDP; más bien, cualquier cepa de E. coli dada , incluso si se considera que no es patógena, puede causar PDS en las cerdas si están presentes otros factores ambientales, genéticos u otros factores que influyen negativamente en la promoción de la infección.
Además de E. coli, se han aislado otras bacterias como cepas de Staphylococcaceae, Streptococcaceae y otras familias de bacterias de la leche de cerdas afectadas con una contribución poco clara a la patogenia real (Awad Masalmeh et al., 1990; Hirsch et al., 2004; Kemper et al., 2013). La mayoría de las especies aisladas son ubicuas en el entorno de las cerdas y pueden originarse a partir de contaminación fecal, urinaria y de otro tipo. Como en el caso de E. coli, otros factores de influencia desfavorables juegan un papel importante en el desarrollo de la enfermedad clínica. Estos factores se pueden atribuir al anfitrión o al medio ambiente.
Sin embargo, debe mencionarse que también otros patógenos pueden causar cuadros clínicos similares al PDS. Por ejemplo, recientemente se ha descrito que Mycoplasma suis causa disgalactia en un rebaño de cerdas belgas (Laitat et al., 2019). Ju et al. (2019) detectaron que Pseudomonas spp. era la bacteria más frecuentemente aislada de lesiones mamarias en cerdas de matadero de Corea del Sur, y sugirieron que podía haber una mayor prevalencia de casos de estos agentes que causan mastitis de lo estimado previamente. La aparición de micotoxinas, que se originan en alimentos mohosos u otros materiales, también se discute como un impacto negativo en la lactancia (Heinritzi et al., 2006).
MANEJO
Los factores ambientales, como la gestión de la crianza y la higiene, así como la alimentación, pueden afectar el curso clínico del PDS. Los resúmenes de los factores de riesgo que aumentan la prevalencia del SDP, según lo estudiado hasta ahora, se analizan en detalle en otro lugar (Papadopoulos et al., 2008a; Gerjets y Kemper, 2009). Con respecto a la probabilidad de que una cerda se vea afectada por PDS, los datos existentes sobre el impacto del número de parto son inconsistentes (Bertschinger et al., 1977b; Baer y Bilkei, 2005). Gerjets et al. (2011a) detectaron un mayor riesgo de desarrollar PDS en cerdas de 1º parto, con camadas de más de 13 lechones nacidos vivos y más de un lechón nacido muerto, y después de la intervención del parto. Estos resultados fueron confirmados porBardehle et al. (2012), revelando relaciones significativas entre PDS, inducción del parto y obstetricia. Las cerdas afectadas por PDS a menudo muestran un parto retrasado o prolongado durante más de 4 h (Tummaruk y Sang-Gassanee, 2013), y por lo tanto es más probable que se les asista en el parto (Berg et al., 2001).
Otro factor de influencia fuertemente correlacionado es la nutrición, por ejemplo, la falta de fibra cruda en la ración (Plonait y Bickhart, 1997) y las condiciones relacionadas con la dieta, como el estreñimiento (Bostedt et al., 1998), que a menudo también es causado por problemas físicos e inactividad de las cerdas periparturientas, ya sea de forma voluntaria o por confinamiento en la jaula de parto. En este contexto, la ingesta suficiente de agua también juega un papel importante (Kruger et al., 2002; Jenny et al., 2015). La nutrición puede influir en el eje gonadal hipotálamo-hipofísico y, por lo tanto, también en la lactogénesis misma, tal como lo revisaron Cosgrove y Foxcroft (1996). Otros factores documentados que aumentan el riesgo de desarrollar PDS son la duración de la gestación que supera los 116 días (Awad Masalmeh et al., 1990), partos prolongados (Petersen, 1983; Bostedt et al., 1998), aparición de infecciones del tracto urinario (Bilkei et al., 1994), altas temperaturas ambientales (Quiniou y Noblet, 1999) e introducción tardía en la paridera después del día 110 de gestación (Valenčak et al., 2006). Peltoniemi et al. (2016) revisaron los datos sobre la provisión de espacio para las cerdas y la oferta de material para la construcción del nido antes del parto, lo que demuestra el potencial para reducir la duración del parto, la tasa de mortinatalidad y el estrés potencial también durante el período de lactancia temprano. Como el estrés es un factor de riesgo para el SDP, tanto el espacio disponible como el suministro de material para anidar pueden tener efectos beneficiosos.
PREDISPOSICIÓN DE LAS CERDAS
Como un factor clave para el resultado clínico de la enfermedad, el estado de defensa del huésped es de gran importancia (Burvenich et al., 2003). Las habilidades individuales de las cerdas para hacer frente a posibles bacterias patógenas son un factor importante en la etiología del PDS, y están influenciadas por muchos factores, como el número de parto, la duración del parto y la variación genética.
Durante algún tiempo se ha discutido una posible predisposición genética al PDS (Ringarp, 1960; Preissler et al., 2012b). Con base en varias definiciones de fenotipos, se ha estimado una heredabilidad que oscila entre el 2 y el 20% (Lingaas y Ronningen, 1991; Berg et al., 2001; Krieter y Presuhn, 2009; Preissler et al., 2012a). En el estudio más reciente, se evaluó una heredabilidad estimada de aproximadamente el 9% en las líneas de cerdas modernas y, con eso, no se puede excluir un trasfondo genético (Preissler et al., 2012a). Por un lado, incluso con este porcentaje de heredabilidad relativamente bajo, el éxito reproductivo es posible como se muestra para la mastitis en vacas lecheras (Heringstad et al., 2003). Por otro lado, una heredabilidad en este rango muestra claramente la importancia de otros factores influyentes y la necesidad de un entorno optimizado. Con tecnologías modernas que permiten estudios de genoma completo, se realizó un 1º estudio para detectar la variación genética en PDS en 5 líneas comerciales de cría de cerdos (Preissler et al., 2013). La susceptibilidad genética al PDS se confirmó en este estudio anterior. Sin embargo, no se identificaron regiones genómicas o genes causales únicos para el PDS, sino varios genes contribuyentes en diferentes regiones: 3 SNP significativos se ubicaron en el cromosoma Sus Scrofa (SSC) 13, SSC 15 y SSC 17 (Preissler et al., 2013).
Estos primeros hallazgos son prometedores para la mejora genética potencial, incluso de rasgos poco hereditarios. No obstante, son necesarios más estudios para validar estos resultados en otras líneas y conjuntos de datos más grandes.
TRATAMIENTO Y PREVENCIÓN
El tratamiento principal del PDS incluye la administración de medicamentos antiinflamatorios no esteroideos (AINE) u otros medicamentos analgésicos para ayudar a las cerdas y permitir que los lechones sigan amamantando (Pendl et al., 2017, Farmer et al., 2019). Para mantener la producción de leche, se puede administrar adicionalmente oxitocina (Hirsch et al., 2003; Gerjets and Kemper, 2009; Pendl et al., 2017). El mantenimiento de la producción de leche, o el suministro de leche por otras fuentes, es esencial para la salud de los lechones. Si ya están debilitados, también se debe proporcionar calefacción adicional.
Teniendo en cuenta el uso prudente de antibióticos, tal como lo exigen las Directrices de la UE sobre el uso prudente de antimicrobianos en medicina veterinaria (2015), la temperatura por sí sola no debe usarse como criterio único para tratar el SDP con antibióticos en las cerdas posparto. El umbral de temperatura se define bastante subjetivamente, y su uso puede ser considerado críticamente, ya que fisiológicamente pueden presentarse aumentos y disminuciones de temperatura, especialmente en el período periparto. Es fundamental realizar un diagnóstico de SDP no solo por aumento de temperatura, sino también en base a una combinación de los criterios adecuados mencionados anteriormente. Se deben evitar los casos de SDP mal diagnosticados para reducir el uso de antimicrobianos y la aparición de cepas bacterianas resistentes a uno o más antibióticos (Silley y Stephan, 2017). Además, los antibióticos solo deben administrarse si el tratamiento con AINE y oxitocina no tuvo éxito.
En granjas de cerdas suecas (Clemensson Lindell et al., 2019) y suizas (Hartmann, 2016), se demostró que el SDP es la razón más frecuente para el tratamiento con antibióticos. Un hallazgo de este último y de otro estudio suizo fue el alto porcentaje (23 a 33%) de “Antimicrobianos de importancia crítica y prioridad más alta” para la medicina humana ( Jenny et al., 2015; Hartmann, 2016), según lo definido por la Organización Mundial de la Salud (2019), como las fluoroquinolonas o las cefalosporinas de 3º y 4º generación utilizadas para el tratamiento del SDP. Además, Jenny et al. (2015) mostró que en el 54% de los tratamientos con antibióticos, la duración del tratamiento fue demasiado corta y en el 19% de ellos la dosis fue demasiado baja, lo que puede tener efectos desencadenantes sobre la resistencia a los antibióticos.
La reducción de la administración de antibióticos en cerdas lactantes no solo se busca por la prevención de la resistencia a los antibióticos, sino también por otras desventajas relacionadas con el uso excesivo. Hartmann (2016) demostró que los tratamientos con antibióticos en cerdas en el período periparto van seguidos de un aumento del tratamiento antimicrobiano de la diarrea, la poliartritis y la corrida en lechones lactantes y destetados. Dado que los antibióticos pueden excretarse parcialmente a través de la leche y afectar el desarrollo de una flora intestinal fisiológica en los lechones, los antibióticos solo deben administrarse después de un diagnóstico confirmado (Oliel, 1995).
Dado que el impacto económico del PDS es significativo, la prevención es lo más importante. De hecho, un modelo que eliminó el riesgo de PDS mostró que el valor del espacio de siembra en 279€ en comparación con el escenario de referencia (Niemi et al., 2017). Las pérdidas económicas se relacionan principalmente con el aumento de las pérdidas de lechones, la menor ganancia de peso en los lechones y la reducción del rendimiento de por vida de la cerda en un parto (Hühn y Rehbock, 1999; Hoy, 2003).
La prevención es, por lo tanto, la mejor manera de hacer frente al SDP en una población, pero difícil de lograr debido a la etiología. A pesar de que se han realizado varios estudios para dilucidar los factores causales y los antecedentes genéticos potenciales, incluida la resistencia individual (Preissler et al., 2013), se desconoce la razón por la que solo algunas cerdas desarrollan signos clínicos de infección después del contacto con bacterias ubicuas. Sin embargo, proporcionar un entorno adecuado y estrategias de alimentación adaptadas para las cerdas antes del parto representa una gran parte de la prevención exitosa a largo plazo. Se demostró que el uso de la alimentación de transición preparto es una herramienta eficaz para reducir la prevalencia del SDP (Pendl et al., 2017). En otro lugar se puede encontrar una descripción general de la literatura reciente sobre la alimentación de las cerdas para facilitar el parto y, con ello, para la prevención del SDP (Peltoniemi et al., 2016). Cabe destacar que se recomienda el suministro de forraje tanto como material de construcción del nido como fuente de fibra para prevenir el estreñimiento.
Se debe tener especial cuidado con las cerdas de riesgo, como las cerdas primíparas y las cerdas con una duración prolongada del parto de más de 4h, porque tienen un alto riesgo de desarrollar trastornos posparto (Tummaruk y Pearodwong, 2015). Como afirman Peltoniemi et al. (2016), se puede suponer que el parto prolongado afecta la salud uterina. Especialmente en las cerdas contemporáneas altamente prolíficas, la duración del parto aumenta debido a la gran cantidad de lechones, y con eso, a menudo también la necesidad de inducción al parto y obstetricia, siendo otros factores de riesgo para el SDP. El efecto de un tamaño de camada más grande en PDS aún no se ha investigado en detalle.
Todas las medidas para reducir los factores de riesgo mencionados en los apartados anteriores son beneficiosas. Las correlaciones entre la fisiología y el comportamiento en torno al parto y la influencia del parto prolongado, la retención de placenta, el desarrollo de PDS y la involución alterada del útero en la producción de calostro y la fertilidad posterior se presentan en una revisión de Peltoniemi et al. (2016). En esta revisión, se dan varias recomendaciones para un parto exitoso y la siguiente lactancia, por ejemplo, la provisión de material adecuado para la construcción del nido, libertad de movimiento y una dieta para reducir el riesgo de estreñimiento y obesidad. Además, se enfatiza la importancia de una corta duración del parto (Peltoniemi et al., 2016). Para facilitar los partos y proporcionar obstetricia si es necesario, los controles regulares, al menos cada hora, en el momento en que se esperan los partos son beneficiosos, también durante los turnos de noche. En cerdas al aire libre, a las que se les permitió moverse libremente, se detectó una menor incidencia de PDS (Mortensen et al., 1994). La ingesta de agua suficiente es esencial para evitar el estreñimiento y puede ser apoyada por una fuente de agua abierta. Un alto nivel general de manejo de la higiene de la granja y medidas específicas para reducir el riesgo de infección, es decir, lavar a las cerdas antes de ingresar al compartimiento de parto, también disminuyen el riesgo de PDS (Hulten et al., 2004). Durante el parto, se debe realizar un alto nivel de higiene. Se debe evitar ensuciar en el período crítico alrededor del nacimiento y la lactancia, y en los corrales o jaulas de parto, la cerda no debe acostarse en sus propias excretas, lo que requiere una eliminación regular de las heces.
RESUMEN Y CONCLUSIONES
Como síndrome multifactorial, el SDP no solo es variable en su cuadro clínico sino también en sus causas subyacentes. En consecuencia, un conocimiento completo de todas las influencias potenciales y su optimización es un requisito previo para criar cerdas y lechones sanos. Con bacterias principalmente ubicuas como patógenos, se debe hacer hincapié en los factores de riesgo no infecciosos. El PDS no es tanto un desafío en el tratamiento, sino más bien en la prevención y el diagnóstico precoz. Como es el caso de casi todas las situaciones en la granja, y especialmente para las enfermedades multifactoriales, el factor humano es de suma importancia: el monitoreo cuidadoso y cercano de los animales es la clave para la identificación temprana de cerdas y camadas en riesgo de desarrollar PDS. La administración de medicamentos practicada a menudo solo en función de un aumento detectado en la temperatura corporal posparto no está justificada profesionalmente.
El uso prudente de antibióticos exige una definición adecuada de los rasgos y, por lo tanto, se deben incluir otros rasgos en el diagnóstico. Un aumento de la temperatura corporal por encima de 39,5°C dentro de las 12 a 48h posparto indica PDS. Sin embargo, deben estar presentes alteraciones clínicas adicionales en las tetinas de las cerdas (enrojecimiento, hinchazón, endurecimiento, etc.) y/o cambios de comportamiento notables en cerdas y lechones para confirmar el diagnóstico. El comportamiento de las cerdas y lechones debe ser el foco de cada observación de rutina de los granjeros o el personal de la granja al revisar los compartimentos de parto, e incluso los cambios leves deben ser objeto de seguimiento. Esto es de especial importancia, sobre todo cuanto mayor sean las exigencias del manejo si el tamaño de la camada es grande. Aumentar el tamaño de la camada ha sido uno de los objetivos de la cría de cerdos en las últimas décadas, pero las líneas de cerdas modernas con camadas grandes representan un desafío en la cría de cerdos, especialmente durante el parto y la lactancia. Las camadas desiguales y la duración prolongada del parto se asocian con el aumento del tamaño de las camadas (Farmer et al., 2019), y este último es un factor de riesgo conocido para PDS. Aún se desconocen otros factores de riesgo que podrían estar relacionados con la etiología del SDP, como los desafíos fisiológicos que enfrentan las cerdas altamente prolíficas durante este período. Incluso con estas correlaciones desconocidas, la documentación de la duración del nacimiento y los posibles problemas, como la necesidad de obstetricia o el PDS posterior, representa una herramienta útil para la prevención cuando las cerdas se seleccionan en función de estos rasgos. Además, todavía hay potencial para adaptaciones y mejoras en los sistemas de maternidad existentes para aumentar la defensa inmunológica general de las cerdas, reducir la presión de infección y disminuir la duración del parto, evitando así el SDP.
Fuente: Anaporc.
Kemper N. Update on postpartum dysgalactia syndrome in sows. J Anim Sci. 2020 agosto; 98 (suplemento 1): S117–S125. Instituto de Higiene, Bienestar y Comportamiento de los Animales de Granja, Universidad de Medicina Veterinaria de Hannover, Alemania.
Referencias
- Angjelovski B., Cvetkovikj A., Mrenoshki S., Radeski M., Cvetkovikj I., Ratkova M. y Dovenski T. 2016. Bacterias Associated with Clinical Postpartum Dysgalactia Syndrome in Farmed Sows in the Republic of Macedonia. Turco. J. Vet. Animación ciencia, 40 (6):776–81.
- Armstrong CH, Hooper BE y Martin CE. 1968. Microflora asociada con el síndrome de agalactia de las cerdas. Soy. J. Vet. Res 29: 1401–07.
- Awad Masalmeh M., Baumgartner W., Passering A., Silber R. y Hinterdorfer F.. 1990. Estudios bacteriológicos en cerdas con mastitis puerperal en diferentes rebaños en Austria . Tierärztl. Umsch . 45 :526–35.
- Bäckström L., Morkoç AC, Connor J., Larson R. y Price W.. 1984. Clinical study of mastitis – metritis – agalactia in sows in Illinois . Mermelada. Veterinario. Medicina. Asoc . 185 :70–73.
- Baer C. y Bilkei G. 2005. Hallazgos patológicos ultrasonográficos y macroscópicos en las glándulas mamarias de cerdas destetadas que han sufrido reincidencia de mastitis metritis agalactia. Reprod. Doméstico. Animo;40 :544–7.
- Bardehle D, Preissler R, Lehmann J, Looft H y Kemper N, 2012. Análisis de parámetros de fertilidad y rendimiento en la producción de lechones considerando la inducción del parto, asistencia al parto y mastitis-metritis-agalactia (MMA). Züchtungskd. 84 (4): 293–306.
- Berg P, Andersen S, Henryon M y Nielsen J, 2001. Variación genética para asistencia al parto y MMA en cerdas y diarrea en sus camadas. En: EAAP, editor. Reunión Anual de la Asociación Europea de Producción Animal; 26 al 29 de agosto de 2001; Budapest, Hungría; pags. 315.
- Bertschinger HU, Bürgi E, Eng V y Wegmann P, 1990. Disminución de la incidencia de mastitis puerperal en la cerda mediante la protección de las mamas contra la contaminación. Suiza. Arco. Tierheilkd. 132: 557–566.
- Bertschinger HU, Pohlenz J y Hemlep I, 1977a. Estudios sobre el síndrome de mastitis-metritis-agalactia (fiebre de la leche) en cerdas. II. Hallazgos bacteriológicos en casos espontáneos. Suiza. Arco. Tierheilkd. 119 :223–233.
- Bertschinger HU, Pohlenz J y Middleton-Williams DM, 1977b. Estudios sobre el síndrome de mastitis-metritis-agalactia (fiebre de la leche) en cerdas. tercero Inducción galactogénica de mastitis inducida por Klebsiella. Suiza. Arco. Tierheilkd. 119 :265–75.
- Bilkei G, Bolcskei A, Clavadetscher E, Goos T, Hofmann C, Bilkei H y Szenci O. 1994. El complejo de enfermedad periparto de la cerda, 1. Evaluación del curso de la bacteriuria de la orina. muestras de cerdas viejas durante el periparto. Berl. Mascar. Tierärztl. Wochenschr. 107 (10): 327-30.
- Bostedt H, Maier G, Herfen K y Hospen R, 1998. Exámenes clínicos en primerizas con septicemia y toxemia puerperal. Tierärztl. Prax. 26 :332–38.
- Burvenich C, Van Merris V, Mehrzad J, Diez-Fraile A y Duchateau L, 2003. La gravedad de la mastitis por E. coli está determinada principalmente por factores relacionados con la vaca. Veterinario. Res. 34:521-54.
- Chase C y Lunney JK, 2019. Sistema inmunológico. En: Zimmerman JJ, Karriker L., Ramirez A., Schwartz KJ, Stevenson GW y Zhang J., editores. Enfermedades de los cerdos. 11ª ed. Hoboke (Nueva Jersey): Wiley-Blackwell; pags. 264–91.
- Clemensson Lindell I, Lindahl E, Lundeheim N y Eliasson-Selig L, 2019. Tratamiento con antibióticos en hatos de cerdos suecos como número de casos de enfermedad tratados en relación con los datos de producción del hato. En: ECPHM, editor. Actas del 11º Simposio Europeo Gestión de la Salud Porcina; 22 al 24 de mayo de 2019. Utrecht, Países Bajos; pags. HHM-PP-47.
- Cosgrove JR y Foxcroft GR. 1996. Nutrición y reproducción en el cerdo: etiología ovárica. Animal. Repr. Ciencia; 42 (1–4 ): 131–41.
- Devillers N, Farmer C, Le Dividich J y Prunier A, 2007. Variabilidad del rendimiento de calostro y la ingesta de calostro en cerdos. Animal 1: 1033–1041.
- Elmore RG y Martin CE, 1980. Agalactia en la terapia actual. En: Morrow DA, editor. Teriogenología 2: diagnóstico, tratamiento y prevención de enfermedades reproductivas en animales. Filadelfia (PA): WB Saunders Co; pags. 1083–6.
- Elmore RG, Martin CE y Berg P, 1978. Absorción de la endotoxina de Escherichia coli de las glándulas mamarias y úteros de cerdas y primerizas en el posparto temprano. Teriogenología 10 :439–45.
- Farmer C, Maes DGD y Peltoniemi OAT, 2019. Sistema Mamario. En: Zimmerman JJ, Karriker L, Ramírez A, Schwartz KJ, Stevenson GW y Zhang J. editores, Diseases of swine. 11ª ed. Hoboke (Nueva Jersey): Wiley-Blackwell; pags. 313–38.


Deja un comentario